近日,色情直播
周翔/田沺教授团队联合刘文博教授团队在Nature Communications 在线发表题为“A catalyst-free bioorthogonal reaction for malononitrile addition to azodicarboxylates”的研究论文,报道了一类无需催化剂的生物正交反应体系 MAAD(malononitrile addition to azodicarboxylates)。黄宏贵博士、刘星宇博士、齐倩倩博士为共同第一作者,刘文博教授、田沺教授为共同通讯作者,色情直播
为唯一通讯单位。

生物正交反应(bioorthogonal reaction)是在复杂生物体系中不干扰天然生命过程的高选择性、高活性人工化学反应。自Staudinger连接、CuAAC(铜催化叠氮-炔环加成)、SPAAC(张力促进环加成)、四嗪-烯烃配对等经典反应体系被发明以来,化学生物学家可以在细胞甚至活体内“精准打标签”,追踪蛋白、糖、脂质和核酸的动态变化,大幅拓展了对生命过程的化学解析能力。然而,现有生物正交反应在实际应用中仍存在如生物兼容性、反应速度、底物合成难度以及与其他反应的正交性等限制,这也推动着新一代生物正交反应的持续发展。
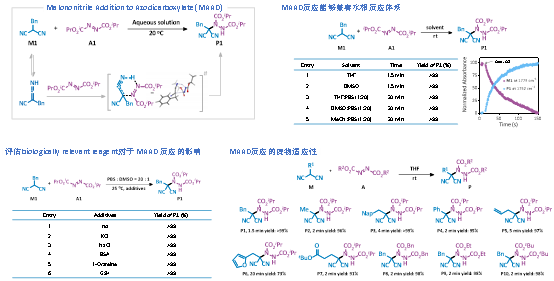
本工作中,研究团队发展了以丙二腈与叠氮二羧酸酯为反应对的MAAD生物正交反应。该反应无需额外催化剂和添加剂,在室温、水溶液及生理条件下即可快速、定量进行,在宽pH范围、离子强度及谷胱甘肽、蛋白等复杂背景下仍保持高选择性和高转化率,底物易于合成和改造,展现出优异的生物兼容性和通用性。
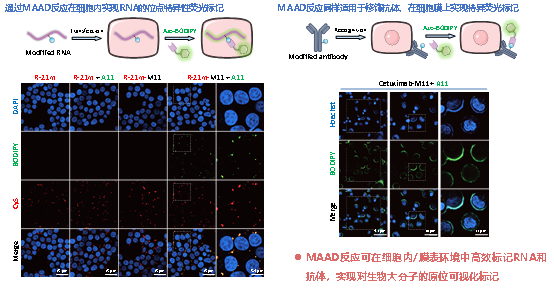
依托这一新正交反应,研究团队构建了多种应用场景:其一,利用带丙二腈手柄的2'-OH 修饰试剂,实现RNA骨架的可控化学标记,再通过MAAD反应“一步点击”连接生物素或荧光基团,用于体外RNA富集和活细胞RNA成像;其二,将丙二腈模块引入蛋白和抗体,结合MAAD反应实现蛋白及细胞膜受体的特异性标记和荧光示踪,为抗体探针和膜蛋白成像提供了新策略。
更具特色的是,作者将MAAD反应嵌入CRISPR体系,将丙二腈手柄修饰在sgRNA/crRNA上,通过MAAD反应在化学修饰位点“放大”空间效应,从而精细调控Cas9和Cas13a的活性,在不影响未修饰体系的前提下,有效控制并改善基因编辑的脱靶问题。这一思路将“标签化学”升级为“功能调控化学”,为提高CRISPR安全性提供了新型工具。
总体而言,MAAD反应兼具新颖反应模式、高度生物兼容性和良好正交性,可在核酸、蛋白标记及基因编辑调控等多层次场景中发挥作用,有望进一步拓展至活体成像、可控基因治疗以及多通道化学生物学工具体系的构建。
论文链接: //doi.org/10.1038/s41467-025-64727-x.